Una innovación biomédica reaviva la esperanza tras un susto cardíaco. La propuesta llega con datos, un calendario preciso y muchas preguntas abiertas.
La cicatriz que deja un infarto no solo cambia la vida; también condiciona cada latido. Un equipo del MIT plantea una respuesta distinta: intervenir el proceso de curación con un parche flexible que libera fármacos de forma programada, acompasado con las fases del daño. En animales, el enfoque ya mostró señales alentadoras y abre una vía para reforzar la capacidad cardíaca cuando el tiempo apremia.
Qué se propone este parche
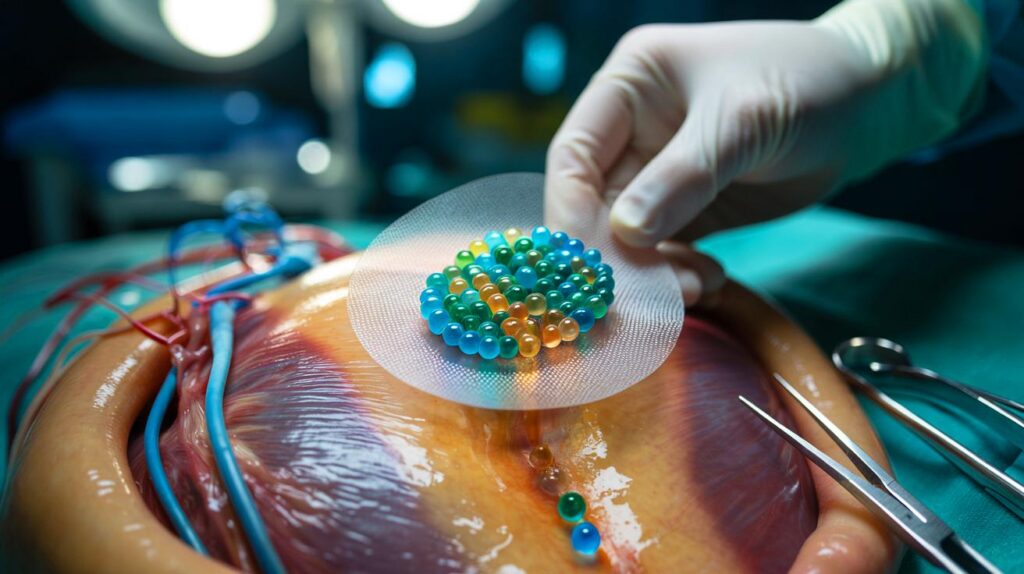
Después de un infarto grave, el corazón pierde tejido funcional y lo reemplaza por cicatriz. La irrigación puede recuperarse con bypass o stents, pero el músculo dañado no vuelve por sí solo. El nuevo dispositivo busca llenar ese vacío: se coloca directamente sobre el corazón durante una cirugía y actúa como un dispensador inteligente que reparte señales bioquímicas en secuencia para favorecer la reparación.
La premisa es simple y potente: entregar, en el lugar exacto, el mensaje correcto en el momento adecuado. Primero se protege a las células amenazadas, luego se promueve la formación de vasos sanguíneos y, por último, se limita la cicatriz.
En ratas, el parche redujo a la mitad el tejido dañado y elevó un 33% la supervivencia frente a comparadores.
La lógica de una terapia cronometrada
El corazón no cura igual el día 1 que el día 10. Por eso, la tecnología usa cápsulas microscópicas que se degradan en momentos distintos. Están hechas de PLGA, un polímero conocido en medicina, al que se ajusta el peso molecular para controlar la velocidad de degradación. Cada lote libera su carga cuando corresponde.
| Ventana temporal | Compuesto | Objetivo biológico |
|---|---|---|
| Días 1 a 3 | Neuregulina‑1 | Evitar muerte celular temprana |
| Días 7 a 9 | VEGF | Inducir nuevos vasos sanguíneos |
| Días 12 a 14 | GW788388 | Frenar la fibrosis y la cicatriz |
Qué hay dentro del material
Las microcápsulas quedan embebidas en un hidrogel delgado —alginato con PEGDA— con textura similar a una lente de contacto. El parche se adapta a la superficie del miocardio, entrega su contenido y se degrada. Al final del proceso, solo persiste una película fina que no interfiere con la función mecánica del corazón.
Este diseño convierte al material en un “programador” de la terapia: una vez suturado, el calendario químico avanza sin depender de bombas externas ni recambios.
El tratamiento queda programado en el material: ubicación precisa, dosis medidas y tiempos definidos.
Qué muestran los primeros ensayos
Antes de pasar a animales, el equipo probó el concepto en esferas de tejido cardíaco generadas a partir de células madre pluripotentes, sometidas a baja oxigenación para imitar el infarto. Se observó más formación de vasos, mejor supervivencia celular y menos señales de fibrosis.
En ratas con infarto, los números llaman la atención por su consistencia. Frente a otras opciones:
- La supervivencia aumentó un 33% durante el seguimiento.
- El área de lesión se redujo aproximadamente un 50%.
- La función global del corazón mejoró de forma significativa.
Los datos no equivalen a una validación clínica, pero justifican avanzar a animales de mayor tamaño, donde el corazón, el flujo y la carga mecánica se parecen más a los humanos.
Cómo podría usarse en la práctica
El candidato típico sería un paciente que llega a cirugía por revascularización —por ejemplo, un bypass— tras un evento extenso. En ese contexto, el cirujano podría colocar el parche sobre el área dañada y cerrar la intervención con la terapia ya “encendida”.
El grupo también trabaja en adaptar el concepto para stents coronarios. La idea sería liberar los fármacos dentro de la arteria con un calendario similar, sin necesidad de abrir el tórax. Si prospera, el alcance se ampliaría a procedimientos percutáneos.
Beneficios potenciales y límites actuales
- Intervención localizada: concentra las señales donde se produjo el daño, sin inundar el organismo.
- Sincronía con la curación: la liberación secuencial acompaña la biología del tejido.
- Degradación controlada: el material se disuelve y evita componentes permanentes voluminosos.
- Limitaciones: requiere cirugía hoy; faltan datos en grandes animales y ensayos humanos; falta definir dosis, duración óptima y perfil de seguridad en poblaciones diversas.
Reducir cicatriz, sumar vasos y proteger células: tres metas que, combinadas, cambian el pronóstico del músculo cardíaco.
Qué falta para que llegue a pacientes
El camino regulatorio incluye validar la biocompatibilidad del hidrogel, la estabilidad de cada compuesto, las interacciones entre capas y el impacto en arritmias. También se deberán estandarizar procesos de fabricación y trazabilidad de las microcápsulas para sostener lotes clínicos.
En modelos grandes se evaluarán parámetros clave: tamaño de la cicatriz por resonancia, fracción de eyección, eventos arrítmicos, inflamación local y complicaciones quirúrgicas. Recién después podrán planificarse ensayos fase I/II para medir seguridad, dosis y señales de eficacia en personas.
Quién podría beneficiarse primero
Probablemente pacientes con infartos extensos, anatomía apta para cirugía y alto riesgo de remodelado adverso. También quienes ya están programados para un bypass y podrían añadir el parche en el mismo acto quirúrgico. Si la versión para stents madura, el espectro incluiría a quienes llegan a angioplastia primaria en las primeras horas del evento.
Lo que puedes hacer hoy si te preocupa el corazón
Ningún dispositivo reemplaza la prevención. Controlar la presión, el azúcar y el colesterol, no fumar, moverse a diario y dormir bien reduce el riesgo de infarto. Ante dolor en el pecho, falta de aire súbita, sudor frío o náuseas, llama a emergencias sin demora. El tiempo de atención repercute en el tamaño de la cicatriz futura.
Si ya tuviste un evento, conversa con tu cardiólogo sobre rehabilitación, adherencia a fármacos y ensayos clínicos activos. Programas de ejercicio supervisado, dieta cardioprotectora y control del estrés mejoran la capacidad cardíaca y la calidad de vida.
Claves técnicas para seguir el tema
PLGA es un polímero usado para liberación controlada de fármacos; ajustar su peso molecular cambia la velocidad de degradación. El hidrogel de alginato con PEGDA da estructura y adhesión temporal sin anclar el parche de forma permanente. La secuencia de señales —antiapoptótica, proangiogénica y antifibrótica— busca modular las fases del daño de manera ordenada.
Riesgos a vigilar cuando avance a clínica: respuesta inmunitaria local, inflamación pericárdica, interferencia con la conducción eléctrica, interacción con otros dispositivos y posibles efectos sistémicos de los compuestos si se alterara el patrón de liberación. Entre las ventajas potenciales figuran menos hospitalizaciones por insuficiencia, mejor tolerancia al esfuerzo y una cicatriz más pequeña, con impacto directo en la función mecánica del corazón.


Incroyable de voir un patch libérer NRG1, puis VEGF, puis un antifibrotique, en suivant le calendrier de cicatrisation. Si la lésion est vraiment réduite de ~50% et la survie +33% chez le rat, c’est énorme. Hâte de voir les essais sur gros animaux.